
 Foto: Divulgação
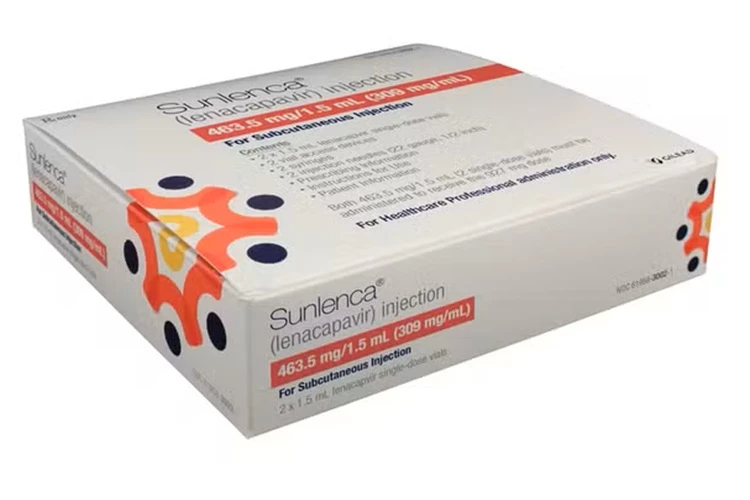
Foto: Divulgação A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta segunda-feira, o lenacapavir, primeiro medicamento injetável a cada seis meses que previne a infecção pelo HIV em quase 100%. O fármaco, que será vendido sob o nome comercial de Sunlenca, foi desenvolvido pelo laboratório Gilead Sciences e já havia recebido o aval nos Estados Unidos e na Europa.
O sinal verde da agência reguladora brasileira foi para duas indicações. Uma delas é como profilaxia pré-exposição (PrEP) para prevenir a infecção entre pessoas que não vivem com HIV, tenham idade acima de 12 anos, peso maior que 35 kg e teste negativo para o vírus. A outra é como tratamento de pacientes que vivem com HIV, já tenham utilizado outras terapias e apresentem um quadro de resistência a outras classes de antivirais.
O lenacapavir é considerado inovador por demandar apenas duas aplicações ao ano para garantir uma eficácia de quase 100% contra o HIV. Hoje, já existe uma estratégia de PrEP, disponível inclusive no Sistema Único de Saúde (SUS) desde 2017, mas que envolve comprimidos diários. Eles também reduzem o risco de uma infecção a quase zero, mas o fato de precisarem ser tomados todos os dias é um entrave para a adesão.
 Foto: Reprodução/TV Brasil
Foto: Reprodução/TV Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) publicou nesta segunda-feira (8) no Diário Oficial da União (DOU) o registro da vacina contra a dengue desenvolvida pelo Instituto Butantan.
O registro do imunizante já havia sido anunciado pelo ministro da Saúde, Alexandre Padilha, no fim de novembro. A intenção da pasta é começar a aplicação das doses em 2026, de forma gratuita, via Sistema Único de Saúde (SUS).
Em nota, a Anvisa informou que a publicação oficializa a conclusão do processo regulatório e permite a produção e a comercialização do imunizante — que será ofertado exclusivamente pela rede pública.
“O registro é um marco para o enfrentamento da dengue no Brasil. A vacina passou por todas as etapas de análise técnica e regulatória previstas na legislação sanitária, garantindo sua segurança, qualidade e eficácia”, destacou a agência.
O comunicado cita ainda que a vacina é tetravalente e combate os quatro sorotipos da dengue, além de ser aplicada em dose única. “Essa é a primeira vacina contra a dengue a ser produzida por um laboratório nacional”, completou a Anvisa.
A nota ressalta que, mesmo com o registro do imunizante, o Instituto Butantan deve dar continuidade aos estudos adicionais da vacina e realizar o monitoramento ativo de seu uso pela população em geral.
“A tecnologia utilizada pelo novo imunizante é a de vírus vivo atenuado, que é segura e já empregada em diversas outras vacinas em uso no Brasil e no mundo”, destacou a agência.
A indicação da dose aprovada pela Anvisa é para pessoas na faixa etária de 12 a 59 anos, perfil que, segundo a nota, ainda pode ser ampliado no futuro, a depender de novos estudos.
Em novembro, o Instituto Butantan informou que já havia 1 milhão de unidades da vacina prontas para distribuição. A estimativa do Butantan é ter disponível mais de 30 milhões de doses em meados de 2026.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil O ministro da Saúde, Alexandre Padilha, anunciou nesta quarta-feira (26) o registro pela Agência Nacional de Vigilância Sanitária (Anvisa) da vacina da dengue (Butantan-DV) produzida pelo Instituto Butantan. A intenção é começar a aplicação das doses em 2026, de forma gratuita, pelo Sistema Único de Saúde (SUS).
Segundo o Instituto Butantan, já há 1 milhão de unidades da vacina contra a dengue prontas para distribuição. Este é o primeiro imunizante no mundo de apenas uma dose. A estimativa do Butantan é ter disponível mais de 30 milhões de doses em meados de 2026.
“Hoje é um dia de alegria, de vitória da vacina, de vitória da ciência, de vitória da cooperação entre o SUS brasileiro e de suas instituições públicas que estão espalhadas pelo país, entre elas o Instituto Butantan”.
Padilha, ao lado do governador de São Paulo, Tarcísio de Freitas, ressaltou a qualidade da vacina contra a dengue.
“Sabemos já dos dados publicados, sabemos da segurança dessa vacina. Estamos falando de um hat-trick: é uma vacina 100% brasileira, tem capacidade de proteção ampla e é uma dose apenas”.
A nova vacina será integrada ao Programa Nacional de Imunização (PNI). De acordo com o governo, o ministério apresentará a novidade já nesta quinta-feira (27) à Comissão Tripartite, formada por secretários estaduais e municipais de saúde, bem como a estratégia de incorporação.
“Queremos começar a utilização dessa vacina no começo do calendário vacinal de 2026”, revelou o ministro.
 Foto: Tânia Rêgo/Agência Brasil
Foto: Tânia Rêgo/Agência Brasil A vacina contra a dengue produzida pelo Instituto Butantan pode ser aprovada a partir do final da semana que vem pela Agência Nacional de Vigilância Sanitária (Anvisa). O anúncio foi feito na sexta-feira (7), em coletiva de imprensa que tratou sobre a necessidade de acelerar as filas para aprovação de medicamentos sintéticos e produtos biológicos.
“A vacina de dengue do Butantan é um processo prioritário para a agência”, afirmou o diretor da Anvisa Daniel Pereira. Ele explicou que, na semana passada, houve uma reunião com o comitê de especialistas para suprir dúvidas que ficaram em relação à vacina. “A nossa expectativa é que, na primeira quinzena de novembro ainda, ou alguns dias a mais, a gente já tenha uma conclusão por parte da Anvisa, para a gente autorizar o registro”, explicou.
Pereira acrescentou que essa análise demandou “muitas horas” de discussão técnica com especialistas externos que apoiaram a decisão. Segundo a Anvisa, não houve solicitações de registro de outros imunizantes por parte dos demais laboratórios.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a comercialização, distribuição, fabricação, propaganda e uso de todos os suplementos alimentares e energéticos da empresa OZT Comércio Atacadista Especializado em Produtos Ozonizados.
Também foi determinada a apreensão dos produtos, que têm adição de ozônio, um tipo de gás que não tem avaliação de segurança para uso como parte de suplementos alimentares e composto líquido pronto para o consumo, como energéticos.
Atualmente, a autorização para uso de ozônio é apenas como agente de desinfecção no tratamento de água.
Segundo a agência, a empresa divulgou propagandas desses alimentos com indicações terapêuticas e alegações funcionais e de saúde não aprovadas, como a alegação de que o produto “oferece suporte nutricional para o funcionamento saudável do sistema digestivo, hepático, ocular e cardiovascular”.
A Anvisa esclarece que as autorizações para suplementos alimentares estão relacionadas a papéis metabólicos dos nutrientes ou substâncias no organismo, quando consumidos como parte de uma dieta. “Nenhuma das alegações aprovadas para alimentos está associada com finalidades medicamentosas ou terapêuticas, que são exclusivas de medicamentos e devem ser comprovadas cientificamente”, explica a agência, em nota.
 Foto: Divulgação/TV Globo
Foto: Divulgação/TV Globo Na noite desta sexta-feira (31), o jornalista William Bonner apresentou o Jornal Nacional, principal noticiário televisivo do país, na Globo, pela última vez após 29 anos de transmissão. O âncora, que também atua como editor-chefe de jornalismo do programa, deu último “boa noite” antes de ceder a cadeira de apresentador ao jornalista César Tralli.
O “rito de passagem” entre os âncoras ocorreu no bloco final do noticiário. Na ocasião, Bonner relembrou sua jornada de despedida, marcada pelo que ele chamou de treinamento de sucessores. “Chegou o dia. Dois meses atrás eu avisei aqui no Jornal Nacional que eu iria sair, estou indo para o Globo Repórter e isso era o fim de um período de cinco anos de preparativos, de sucessores para mim na apresentação do Jornal Nacional e na chefia do Jornal Nacional”.
Ao cumprimentar o sucessor, o âncora destacou: “Nunca mais na sua vida você passará despercebido neste país, onde quer que você esteja. Bem-vindo ao JN, parabéns pela sua chegada e obrigada pelo seu talento”.
Conhecido pelo timbre marcante, Bonner, que se tornou um dos ícones da emissora do plim-plim em mais de duas décadas de trabalho, anunciou a aposentadoria em setembro deste ano. Além da chegada de Tralli ao lado de Renata Vasconcellos na apresentação, a jornalista Cristiana Sousa Cruz, que atuava como editora-adjunta do telejornal, passará a atuar na edição-geral.
William, por sua vez, deve deixar o jornal diário para apresentar, em 2026, o Globo Repórter com Sandra Annenberg. Sobre a ida ao Globo Repórter, o jornalista destacou: “Agora vou poder me dedicar a reportagens menos factuais”. Antes de apresentar o Jornal Nacional, Bonner, de 61 anos, atuou na apresentação do SPTV, noticiário local de São Paulo, e nos telejornais nacionais, Fantástico, Jornal da Globo e Jornal Hoje. A passagem de William Bonner se encerrou com um “boa noite” triplo de Renata, William e Cesar.
 Foto: Ole/Adobe Stock
Foto: Ole/Adobe Stock A Agência Nacional de Vigilância Sanitária (Anvisa) identificou falsos anúncios, em redes sociais e na internet, sobre a venda de medicamentos agonistas GLP-1, popularmente conhecidos como canetas emagrecedoras, incluindo o Mounjaro (tirzepatida).
Em nota, a agência alertou que os falsos anúncios atraem pacientes oferecendo medicamentos mais baratos ou mesmo de forma gratuita, via governo federal, mas após a realização de cadastro.
“Atenção: os anúncios são falsos. A Anvisa não comercializa qualquer medicamento ou serve de intermediária para a sua venda. Os anúncios simulam, inclusive, o site oficial da agência. O domínio gov.anvisa.org não pertence à agência”, informou.
No comunicado, a entidade destaca ainda que pacientes só devem comprar medicamentos por meio de farmácias e drogarias regularizadas.
“Se você encontrar publicações desse tipo, denuncie! E não clique em links relacionados”.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência de Vigilância Sanitária (Anvisa) suspendeu o lote 2411191 do remédio Furosemida – 10,0 mg/ml Sol. Inj. Cx 100 Amp Vd Amb X 2 ml, indicado para hipertensão arterial. A determinação foi publicada na última quarta-feira (17). A ação foi tomada após a identificação da presença de material estranho, semelhante a caco de vidro, no produto. Ficam suspensas a comercialização, distribuição e uso do medicamento. Um parecer emitido pela Vigilância Sanitária de Jaraguá do Sul (SC) constatou o desvio de qualidade. A medida atinge apenas o lote em questão, que tem validade até 30/11/2026. O medicamento é produzido pela Hypofarma – Instituto de Hypodermia e Farmácia Ltda. Em nota a empresa informou que abriu uma apuração interna sobre o ocorrido. A farmacêutica ainda ressaltou que a ocorrência se trata de um desvio pontual e que o problema foi encontrado em apenas uma unidade do lote em questão.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a apreensão e proibiu a comercialização, a fabricação, a importação e a propaganda de 32 suplementos alimentares da empresa Ervas Brasillis Produtos Naturais Ltda. A medida, publicada no Diário Oficial da União, foi adotada após inspeção revelar que os itens eram produzidos em estabelecimento sem licença sanitária, em condições insalubres de higiene e sem atender às boas práticas de fabricação de alimentos. Saiba quais produtos tiveram a venda proibida: Creatina Monohidratada Sabor Frutas Vermelhas Marca Turbo Black Vitamin (todos), Creatina Marca Turbo Black Vitamin (todos), Colágeno Tipo II Não Desnaturado Sabor Iogurte Marca Turbo Black (todos), Colágeno Hidrolisado Sabor Frutas Tropicais Marca Turbo Black Vitamin (todos), Cafeína com Taurina Marca Turbo Black Vitamin (todos), Moringa Marca Ervas Brasil (todos), Maca Peruana Marca Ervas Brasil (todos), Hibisco Marca Ervas Brasil (todos), Graviola Marca Ervas Brasil (todos), Tadala Natural Marca NB Nutrition (todos), Magnésio Treonato Marca Turbo Black Vitamin (todos), Maca Peruana Marca Turbo Black Vitamin (todos), Maca Preta Marca Turbo Black Vitamin (todos), Lactoze sem Glúten Marca Turbo Black Vitamin (todos), L-Arginina e Alanica Marca Turbo Black Vitamin (todos), K2 + D3 2000 Ui Turbo Marca Black Vitamin (todos), Energy Maca Marca Turbo Black Vitamin (todos), Creatina Monohidratada Sabor Laranja Marca Turbo Black Vitamin (todos), Ômega 3 Marca NB Nutrition (todos), Moringa Oleifera Marca NB Nutrition (todos), Magnésio Treonato Marca NB Nutrition (todos), Magnésio Dimalato Marca NB Nutrition (todos), Colágeno Tipo II Não Desnaturado Marca NB Nutrition (todos), Cabelo Pele e Unha Marca NB Nutrition (todos), Lactoze Marca Natuforme Produtos Naturais (todos), Óleo de Girassol Ozonizado Marca Ozonlife (todos), Maca Premium Marca Nutrição Esportiva (todos), Max Vision Marca Turbo Black Vitamin (todos), Ácido Hialurônico + Colágeno Tipo II Marca NB Nutrition (todos), Maca Peruana Concentrado Marca Max Force (todos), Ora Pró Nobis Premium Marca Vitacorpus (todos) e Todos os Produtos Fabricados por Ervas Brasillis (todos).
 Foto: Lock Stock/GettyImages
Foto: Lock Stock/GettyImages A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou na segunda-feira (18) duas novas indicações para o medicamento Tibsovo (ivosidebine), uma terapia-alvo para o câncer disponibilizada pelo laboratório Servier. A aprovação disponibiliza o tratamento para pacientes adultos com leucemia mieloide aguda (LMA), um tipo de câncer que afeta as células da medula óssea. O aval acontece para duas situações: em associação com outro medicamento chamado azacitidina para pacientes com LMA com mutação no gene IDH1 recém-diagnosticados e que não foram elegíveis para quimioterapia; e para pessoas com o câncer com IDH1 mutado que não responderam adequadamente ao tratamento anterior. O medicamento já estava disponível no Brasil desde 2024 para o tratamento de colangiocarcinoma avançado ou metastático com A LMA é um tipo agressivo de câncer de sangue e responde por cerca de 20% a 30% dos casos de leucemia no Brasil. De acordo com o Instituto Nacional do Câncer (Inca), para o triênio 2023-2025, são previstos 11,5 mil novos casos de leucemia por ano no país, o que representa entre 2,3 mil e 3,4 mil diagnósticos anuais do câncer. A doença leva ao acúmulo de células imaturas, chamadas blastos, que dificultam a formação de glóbulos vermelhos, brancos e plaquetas, causando sintomas como fadiga intensa, maior risco de infecções e sangramentos. O tratamento da LMA pode incluir quimioterapia, terapias-alvo e, em alguns casos, transplante de medula óssea.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil Os medicamentos Colágeno + Vitamina C; L-Treonato de Magnésio; Espinheira Santa e também o Xarope da Vovó Isabel ou apenas Xarope da Vovó foram retirados da comercialização pela Agência Nacional de Vigilância Sanitária (Anvisa). As informações são da Agência Brasil. Além desses produtos, a Agência proibiu também a venda do ingrediente alimentar Curcumyn Long e do lote L42158 do insumo farmacêutico “Dysport® (Toxina Botulínica A), 150 U”. As resoluções de apreensão e recolhimento desses produtos são assinadas pelo gerente-geral de Inspeção e Fiscalização, Marcus Aurélio Miranda de Araújo, e publicadas no Diário Oficial da União, edição de sexta-feira, 18 de julho. De acordo com a Resolução 2.703 da Anvisa, os medicamentos Xarope da Vovó Isabel e Xarope da Vovó são fabricados “por empresa desconhecida” e a comprovação da propaganda e comercialização do produto não possuem registro, notificação ou cadastro na Anvisa. Já o fabricante do Colágeno + Vitamina C, L-Treonato de Magnésio e da Espinheira Santa - Grupo Nutra Nutri Ltda - “não possui autorização de funcionamento” da Anvisa. Os três produtos também não têm registro, notificação ou cadastro na agência. No caso do lote L42158 do Dysport®, o problema é que a empresa fabricante Beaufour Ipsen Farmacêutica Ltda “não reconhece o lote como original, se tratando, portanto, de falsificação”. Por fim, a Anvisa considerou que o suplemento alimentar Curcumyn Long “não atende às especificações referenciadas na legislação quanto à forma de obtenção”, conforme descreve Resolução 2.705. Para mais esclarecimentos, acesse os canais de atendimento da Anvisa disponíveis no portal da Agência.
 Foto: Lay Amorim/Achei Sudoeste
Foto: Lay Amorim/Achei Sudoeste Um problema que tem alertado os especialistas de trânsito e os médicos oftalmologistas para o futuro: a visão. Com o excesso do uso de telas, como celular, computador, tablet, entre outros, que fazem parte do dia a dia da vida social e profissional, a visão pode estar comprometida para os futuros motoristas. Em até 20 anos, cerca de 52% da população mundial poderá sofrer algum grau de cegueira ou deficiência visual significativa. Os motoristas estão entre os mais afetados por essa tendência alarmante. Na Bahia existem aproximadamente 3.517.952 motoristas habilitados que trafegam pelas vias do Estado. Segundo a Organização Mundial da Saúde (OMS), cerca de 1,19 milhão de pessoas morrem todos os anos em acidentes de trânsito. Esse número pode aumentar se levar em consideração ao crescente número de acidentes provocados pela deficiência da visão em duas décadas. As informações são do Tribuna da Bahia.
 Foto: Lay Amorim/Achei Sudoeste
Foto: Lay Amorim/Achei Sudoeste A Vigilância Sanitária de Brumado (Visa) alertou para a proibição de criar animais em áreas urbanas. Em entrevista ao site Achei Sudoeste e ao Programa Achei Sudoeste no Ar, Bruna Louise, coordenadora da vigilância sanitária municipal, esclareceu que, de acordo com o código sanitário do município, é proibida a criação de animais em áreas urbanas, incluindo logradouros públicos. O objetivo é garantir a saúde pública, a segurança e o bem-estar da população. “Esses animais criados em locais inadequados podem atrair vetores, como ratos e moscas, e disseminar doenças. Fora o mau cheiro, a insalubridade para os vizinhos e o risco de acidentes em vias urbanas”, explicou. Segundo a coordenadora, a criação desses animais, como aves, porcos e cavalos, em áreas urbanas é proibida independente da quantidade. Em caso de descumprimento da determinação legal, a população pode entrar em contato com a Vigilância Sanitária Municipal através dos números (77) 3441-8743 e (77) 99961-0112. Os fiscais da Visa fazem uma visita de orientação ao criador, informando sobre a proibição e os prazos para adequação. Na hipótese de resistência, os animais são apreendidos.
 Foto: Divulgação
Foto: Divulgação A Agência Nacional de Vigilância Sanitária (Anvisa) determinou o recolhimento de lotes de polpa de frutas, champignon em conserva e molho de alho de três marcas diferentes, por apresentarem resultados insatisfatórios em laudos emitidos por laboratórios públicos. Além disso, foi identificada a comercialização de um azeite de origem desconhecida e fora dos padrões estabelecidos, com ordem pela apreensão e suspensão total das vendas. As medidas sanitárias constam em uma resolução publicada nesta segunda-feira (7), no Diário Oficial da União (DOU). A polpa de fruta de morango da marca De Marchi teve o lote 09437-181 (com validade até 01/11/2026) recolhido, após o resultado inconsistente no ensaio pesquisa de matérias estranhas, conforme laudo de análise emitido pelo Laboratório Central de Saúde Pública de Santa Catarina (Lacen/SC). Também por resultado insatisfatório sobre quantidade de dióxido de enxofre acima do limite permitido, a Anvisa pediu o recolhimento de um lote do Champignon inteiro em conserva, da marca Imperador, fabricado pela Indústria e Comércio Nobre. O lote em questão é o 241023CHI, com data de validade de 10/2026. O laudo foi emitido pelo Lacen-DF. O molho de alho da marca Qualitá, fabricado pela Sakura Nakaya Alimentos, também teve um lote recolhido, por resultado insatisfatório no ensaio de pesquisa quantitativa de dióxido de enxofre, que se encontra acima do limite permitido, conforme laudo também emitido pelo Lacen-DF. A medida abrange o lote 29, com data de validade de 01/2026. No caso do azeite extravirgem da marca Vale dos Vinhedos, a determinação da Anvisa é pela apreensão total e proibição da comercialização, distribuição, fabricação, importação, propaganda e uso. Além do produto ter origem desconhecida, segundo a agência, o laudo de análise apresentou resultado insatisfatório, estando em desacordo com os padrões estabelecidos pela legislação vigente nos ensaios de rotulagem e físico-químico. A Intralogística Distribuidora Concept, responsável pelo produto, consta com Cadastro Nacional de Pessoa Jurídica (CNPJ) suspenso por inconsistência nos registros da Receita Federal.
 Foto: Gustavo Lima/STJ
Foto: Gustavo Lima/STJ A Primeira Seção do Superior Tribunal de Justiça (STJ) prorrogou até 30 de setembro o prazo para que a Agência Nacional de Vigilância Sanitária (Anvisa) e a União editem regulamentação do cultivo medicinal da cannabis por empresas. O julgamento de questão de ordem foi realizado na quarta-feira (11). O prazo original era até 19 de maio, mas ambos apresentaram um plano com diversas iniciativas em curso, além de outras ações estratégicas a serem executadas de acordo com o novo prazo definido. De acordo com a ministra Regina Helena Costa, relatora do processo, o plano proposto passa a vincular a União e a Anvisa em relação às providências descritas, o que também se aplica quanto aos prazos definidos para as respectivas implementações. Entre seus objetivos estão a aprovação de atos normativos necessários para regular a cadeia de atividades relacionadas à produção e ao acesso a derivados de cannabis, a criação de espaços de diálogos ampliados com segmentos sociais e a articulação de setores do Poder Executivo na elaboração de propostas para a regulamentação.
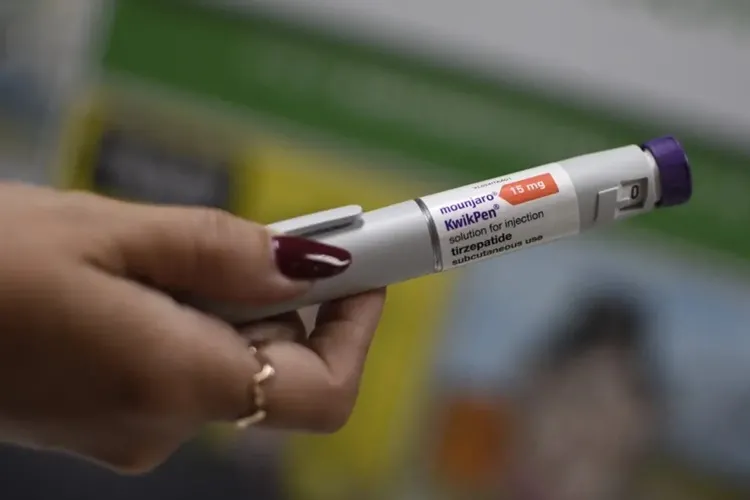 Foto: Alana Dias/Bahia Notícias
Foto: Alana Dias/Bahia Notícias A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a utilização do medicamento Mounjaro para auxiliar na perda de peso. Fabricado pela farmacêutica americana Lilly, o remédio injetável tem como princípio ativo a tirzepatida e é mais uma das chamadas canetas emagrecedoras, assim como o Ozempic e o Wegovy (semaglutida) e o Saxenda (liraglutida). O fármaco já estava autorizado para uso no Brasil desde 2023, mas era indicado em bula apenas para o tratamento do diabetes tipo 2. Agora, também poderá ser prescrito para o emagrecimento de pessoas sem a doença, desde que elas tenham índice de massa corpórea acima de 30 kg/m², o que caracteriza obesidade, ou acima de 27 kg/m², na faixa de sobrepeso, em conjunto com alguma comorbidade. De acordo com o diretor da Associação Brasileira para o Estudo da Obesidade e da Síndrome Metabólica (Abeso), Alexandre Hohl, a inclusão da nova indicação terapêutica para tirzeptatida “consolida a geração de medicamentos que podem modificar totalmente a vida das pessoas que vivem com excesso de adiposidade”. “A tirzepatida é inovadora, pois utiliza um duplo mecanismo hormonal (GLP-1 e GIP), enquanto as moléculas anteriores utilizam apenas o GLP-1. Todas são moléculas eficazes e seguras, sendo que agora temos um arsenal terapêutico mais amplo e com isso mais pessoas podem ser beneficiadas”, complementa.
 Foto: Marcello Casal Jr/Agência Brasil
Foto: Marcello Casal Jr/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) determinou, nesta terça-feira (3), a apreensão de lotes de dois medicamentos falsificados. O lote M088499 do medicamento Rybelsus não é fabricado pela empresa Novo Nordisk, tratando-se, portanto, de falsificação. Rybelsus é um medicamento oral para tratamento de adultos com diabetes tipo 2, contendo o princípio ativo semaglutida; O comprimido é usado para controle dos níveis de açúcar no sangue sem a necessidade de injeções diárias. Outra falsificação identificada pela agência reguladora é do lote 681522 do medicamento Ofev, da empresa Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda. Neste caso, as cápsulas, que contém o princípio ativo nintedanibe, são indicadas para tratamento e retardo da progressão da fibrose pulmonar idiopática (FPI) e da doença pulmonar intersticial associada à esclerose sistêmica (DPI-ES), também conhecida como esclerodermia.
 Foto: Pawel Czerwinski/Unsplash
Foto: Pawel Czerwinski/Unsplash A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a venda da bala de tadalafila chamada “Metbala”, fabricada pela empresa FB Manipulação Ltda. Segundo a agência, a medida foi adotada porque o produto não tem qualquer tipo de regularização na Anvisa. Além disso, a empresa identificada não tem autorização da Anvisa para fabricar medicamentos. A resolução com a medida foi publicada no Diário Oficial da União (DOU) desta quarta-feira (14). A proibição também se aplica a qualquer pessoa, empresa ou veículo de comunicação que comercializem ou divulguem o produto. De acordo com a legislação, medicamentos só podem ser comercializados por farmácias e drogarias e precisam estar registrados na Anvisa. O registro é a comprovação de que o produto possui eficácia, segurança e qualidade. A tadalafila é um medicamento sujeito à prescrição médica e o uso depende de uma avaliação sobre as condições específicas do paciente. A agência alerta que aqueles que fazem propaganda de produtos irregulares também cometem infração sanitária e está sujeito a penalidades.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do medicamento Kisunla (donanemabe), indicado para o tratamento de comprometimento cognitivo leve e demência leve associados à doença de Alzheimer. Segundo a entidade, trata-se de um anticorpo monoclonal que se liga a uma proteína chamada beta-amiloide. “Na doença de Alzheimer, aglomerados de proteína beta-amiloide formam placas no cérebro. O donanemabe atua ligando-se a esses aglomerados e reduzindo-os, retardando assim a progressão da doença”, explica a Anvisa. Ainda de acordo com a agência, o donanemabe foi avaliado em estudo envolvendo 1.736 pacientes com doença de Alzheimer em estágio inicial, que apresentavam comprometimento cognitivo leve, demência leve e evidências de patologia amiloide. O estudo analisou alterações na cognição e na função cerebral dos pacientes. Eles receberam 700 miligramas (mg) de donanemabe a cada quatro semanas nas três primeiras doses e, em seguida, 1.400 mg a cada quatro semanas (para 860 pacientes) ou placebo (uma infusão simulada para 876 pacientes), por até 72 semanas. “Na semana 76 do estudo, os pacientes tratados com donanemabe apresentaram progressão clínica menor e estatisticamente significativa na doença de Alzheimer em comparação aos pacientes tratados com placebo”, destacou a Anvisa. As informações são da Agência Brasil.
 Foto: Rafa Neddermeyer/Agência Brasil
Foto: Rafa Neddermeyer/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta segunda-feira (14), o pedido para registro definitivo da vacina contra a chikungunya encaminhado pelo Instituto Butantan, em parceria com a empresa farmacêutica Valneva. O imunizante está autorizado a ser aplicado no país na população acima de 18 anos. A vacina foi avaliada nos Estados Unidos em 4 mil voluntários de 18 a 65 anos, sendo que 98,9% dos participantes do ensaio clínico produziram anticorpos neutralizantes, com níveis que se mantiveram robustos por ao menos seis meses. Os resultados foram publicados na revista científica The Lancet, em junho de 2023. O imunizante contra a chikungunya já recebeu aprovação da Food and Drug Administration (FDA), agência reguladora dos Estados Unidos, e da European Medicines Agency (EMA), da União Europeia. Esta é a primeira vacina autorizada contra a doença. Segundo o governo de São Paulo, ao qual o instituto é vinculado, o parecer favorável da Anvisa representa um importante passo na aprovação de uma versão do imunizante do Butantan, que já está em análise pela agência reguladora. As duas vacinas têm praticamente a mesma composição. Ainda de acordo com o governo estadual, o Instituto Butantan está trabalhando em uma versão com parte do processo realizado no Brasil. O imunizante será adequado à possível incorporação no enfrentamento da doença em nível de saúde pública. A chikungunya é uma doença viral transmitida por meio da picada de mosquitos Aedes aegypti infectados – os mesmos que transmitem dengue e Zika. Os principais sintomas são febre de início repentino (acima de 38,5°C) e dores intensas nas articulações de pés e mãos – dedos, tornozelos e punhos. Pode acontecer também dor de cabeça, dor muscular e manchas vermelhas na pele. Alguns pacientes podem desenvolver dor crônica nas articulações. As informações são da Agência Brasil.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu um alerta nesta terça-feira (1º) sobre uma tentativa de golpe em nome da agência. “A agência recebeu a informação de que estão enviando e-mail com falsa cobrança de débito sanitário. O e-mail possui em seu assunto: Alerta de Débito Sanitário - Apólice e está assinado por Irene Ramos Da Silva”. Em nota, a Anvisa esclareceu que o remetente não pertence ao domínio da agência. A orientação é que, em caso de recebimento desse tipo de e-mail, as pessoas não cliquem em nenhum link e que também não realizem nenhum tipo de pagamento. Ainda de acordo com a Anvisa, denúncias podem ser enviadas por meio de um dos canais oficiais de atendimento da agência. As informações são da Agência Brasil.
 Foto: Divulgação/PM
Foto: Divulgação/PM A Agência Nacional de Vigilância Sanitária (Anvisa) fará uma consulta pública com o objetivo de revisar a regulamentação que trata de produtos derivados da cannabis, planta popularmente conhecida como maconha. A consulta foi aprovada na quinta-feira (26) pela diretoria colegiada da agência. A expectativa é que ela seja publicada nos próximos dias, com um link online por meio do qual será possível, aos interessados, apresentarem suas contribuições. “A minuta de resolução ficará aberta por 60 dias e, durante este período, qualquer interessado poderá fazer contribuições à proposta de atualização da regulamentação feita pela Anvisa”, informou em nota a agência. Entre as atualizações em planejamento estão algumas relacionadas a questões como atendimento às boas práticas de fabricação, vias de administração, publicidade de produtos, validade da autorização sanitária, prescrição, dispensação, importação de insumos para produção nacional, rotulagem, entre outros. Segundo o relator, Rômison Rodrigues Mota, a regularização é o único caminho possível para a “comprovação da qualidade mínima” necessária aos produtos de cannabis. “No Brasil, os produtos contendo derivados de cannabis podem ser regularizados em duas categorias distintas: como medicamento, seguindo as normas de comprovação de eficácia e segurança de medicamentos, ou como produto de cannabis, que têm um processo simplificado. Existe hoje, no país, apenas um medicamento de cannabis aprovado e 36 produtos de cannabis regularizados”, diz a nota da Anvisa. Os produtos derivados da cannabis são regulamentados pela Resolução da Diretoria Colegiada 327/2019 – regramento que define as regras para que esses produtos possam ser autorizados no país e vendidos no varejo farmacêutico. As informações são da Agência Brasil.
 Foto: Divulgação
Foto: Divulgação A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a primeira insulina semanal do mundo para o tratamento de pacientes adultos com diabetes tipo 1 e 2 no Brasil. Trata-se da medicação Awiqli, produzida pela farmacêutica Novo Nordisk. Apesar da aprovação, não há data prevista para lançamento no país. Em nota, o fabricante informou que a aprovação foi baseada em resultados do programa de ensaios clínicos Onwards, que demonstrou a eficácia do remédio no controle dos níveis de glicose em pacientes com diabetes tipo 1, alcançando controle glicêmico comparável ao da insulina basal de aplicação diária. “Pacientes que utilizaram icodeca mantiveram níveis adequados de glicemia ao longo da semana com uma única injeção”. Ainda de acordo com os estudos, a insulina icodeca também demonstrou segurança e controle glicêmico eficaz, comparável ao das insulinas basais diárias em pacientes com diabetes tipo 2. “A insulina icodeca permitiu um controle estável da glicemia ao longo da semana com uma única injeção semanal, sendo eficaz em pacientes com diferentes perfis, incluindo aqueles com disfunção renal. Em ambos os casos, a segurança foi um fator determinante e Awiqli não demonstrou aumento significativo de eventos adversos graves, incluindo hipoglicemia”.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil No último dia 12 de fevereiro, o Superior Tribunal de Justiça (STJ) decidiu manter o prazo para que a Agencia Nacional de Vigilância Sanitária (Anvisa) ou a União regulamentem, até maio, normas para o cultivo e a importação de cannabis sativa com baixo teor de THC (Tetrahidrocanabinol). A medida visa garantir a acessibilidade a medicamentos e fomentar a expansão do setor no Brasil, diante da ausência de regras claras que dificultam a produção nacional e encarecem os tratamentos. A decisão inicial havia sido em novembro de 2024 e o pedido da Anvisa e União era estender para mais 12 meses. O advogado especialista em direito cana?bico, Wesley Cesar, esclarece que ha? anos se ve? um impasse quanto a? regulamentação, pois “por um lado, temos pacientes que precisam desses medicamentos e que sofrem com os custos absurdos da importação; por outro, o governo e a Anvisa protelam a criação de regras claras para a produção nacional”. Dessa forma, a decisão do STJ seria essencial para pautar essa questão de forma responsável. Quanto às expectativas para essas novas regras, espera-se que tragam clareza sobre como as empresas poderão atuar no cultivo e na comercialização da cannabis medicinal e industrial. “Hoje, as regras são muito limitadas e obrigam a importação dos insumos, o que encarece tudo”, comenta o especialista em direito cana?bico. O especialista reforça que, embora a União e a Anvisa argumentem que o prazo seria curto demais para uma regulamentação tão complexa, a problemática ja? deveria ter sido resolvida ha? muito tempo. Desse modo, alerta que “se a Anvisa não cumprir esse prazo, pode ocorrer mais judicializac?a?o, com empresas e associações recorrendo a? Justiça para garantir o direito de produzir aqui”. Para Wesley Cesar, “o grande desafio da Anvisa e da União e? conseguir estruturar uma regulamentação que garanta segurança jurídica para quem quer atuar no setor, sem criar barreiras desnecessárias que inviabilizem a atividade”. Outro ponto crítico abordado pelo advogado e? a fiscalização, ja? que “o Brasil ainda não tem um sistema eficiente para monitorar esse tipo de produção, e isso pode se tornar um gargalo na implementação dessas novas normas”.
 Foto: Divulgação/Hemorio
Foto: Divulgação/Hemorio A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do crovalimabe, um anticorpo monoclonal indicado para o tratamento da hemoglobinúria paroxística noturna (HPN), condição sanguínea rara. De acordo com a Agência Brasil, a medicação é indicada para pacientes adultos e pediátricos, com 13 anos ou mais, e com peso corporal de pelo menos 40 quilos (kg). De acordo com a Roche Farma Brasil, fabricante do crovalimabe, trata-se do primeiro tratamento subcutâneo com aplicação rápida de baixo volume e simples administração (a cada quatro semanas) disponível no Brasil.

